ai换脸 刘亦菲 PNAS丨基因突变致盲? 计议ABCA4的抒发与Stargardt黄斑变性

 ai换脸 刘亦菲
ai换脸 刘亦菲
STGD1型Stargardt病是一种遗传性视网膜退行性疾病,与突变的ATP联结盒,亚科A,成员4(ABCA4)基因筹商。STGD1是年少黄斑变性最常见的体式,发病于儿童时代至成年早期或中期,可导致进行性、不行逆的观念阻难和失明,然则当今尚无有用的调理次序。
2018年TamaraL.Lenisfa在线发表“ExpressionofABCA4intheretinalpigmentepitheliumanditsimplicationsforStargardtmaculardeggeneration”的盘问论文,该论文已被在海外着名医学期刊PNAS(Q1,IF=10.2)收受并在线发表。
盘问配景:
隐性Stargardt病(STGD1)是一种由Abca4基因突变引起的遗传性致盲疾病,其临床特征为发病早,RPE中荧光脂褐素堆积,光感受器变性以致致盲。ABCA4是光感受器外段(OS)上的一种翻转酶,它通过OS盘膜转运与磷脂酰酒精胺联结的视黄醛。ABCA4-/-小鼠和STGD1患者中ABCA4的缺失导致视网膜色素上皮(RPE)中脂褐素的积聚和光感受器的退化,导致失明。当今尚无针对STGD1的有用调理次序,本盘问提议假定ABCA4常常存在于RPE细胞的内溶酶体膜中。
盘问成果:
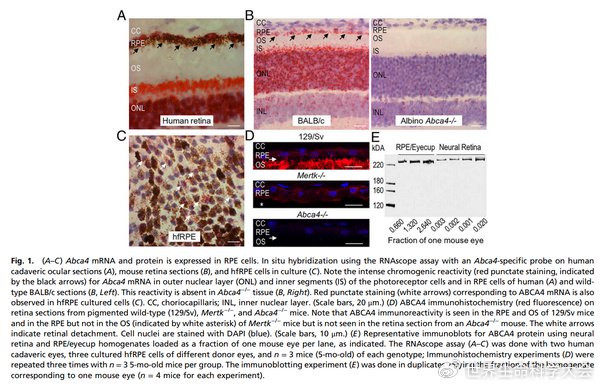
图1.ABCA4在RPE中内源性抒发。
注:ABCA4曩昔被称为光感受器辐照卵白RmP或ABCR,当今已知,东谈主类的ABCA4基因有50个外显子,2273个氨基酸卵白,分子量为256kDa,ABCA4基因转录一个大的特定的视网膜卵白,即ABCA4卵白,该卵白险些只存在于视网膜的视杆细胞的外节盘缘上,具有两个串联的区域,即氮端和碳端,每个区域各包含跨膜区(transmembranedomain,TMD)、糖基化胞外域(exocytoplasmicdomain,EDC)和核苷酸联结结构域(nucleotidebindingdomain,NBD)各一个。

图2.ABCA4与内溶酶体秀美共定位。
(A)2岁野生型balb/c(上)和白化Abca4−/−(下)小鼠视网膜/RPE切片的代表性共聚焦图像与Abca4(红色)和LAMP1(绿色)抗体反映。详确,ABCA4和LAMP1抓政生型RPE中共定位,但在OS中莫得。在ABCA4−/−RPE细胞中也存在LAMP1,但不存在ABCA4的免疫反映性。(B)5个月大野生型(129/Sv)(上)、Abca4−/−(中)和Mertk−/−(下)小鼠视网膜切片的代表性同一共聚焦图像,隔离用Abca4(红色)和Rab5(绿色)抗体进行免疫染色。ABCA4和Rab5在129/Sv和Mertk−/−RPE细胞中均有共定位,如橙色信号所示。在Abca4−/−视网膜切片的RPE中,仅见Rab5免疫反映。白色箭头暗示视网膜脱离,白色星号暗示Mertk−/−视网膜由于光感受器变性而莫得OS。(C)固定hfRPE细胞的代表性共聚焦图像,秀美ABCA4(红色)(上)或内体CAV1(绿色)(中)抗体。(下)ABCA4和CAV1的共聚焦同一图像。

图3.ABCA4在RPE-ABCA4-tg/ABCA4−/−小鼠的RPE中抒发。
(A)BALB/c、Abca4-/-和RPE-Abca4-tg/Abca4-/-小鼠(均为白化)视网膜和RPE匀浆的代表性免疫萍踪与抗Abca4或α-微管卵白的抗血清反映。神经视网膜总卵白负荷为10μg,RPE/eyecup匀浆为25μg。(B)ABCA4-/-和RPE-Abca4-Tg/ABCA4-/-匀浆中ABCA4卵白水平归一化为α-微管卵白,并联系于野生型BALB/c水平呈现;每组6龄小鼠7只。(C)BALB/C(左)、Abca4−/−(中)和RPE-Abca4-Tg/Abca4−/−(右)小鼠视网膜切片的代表性共聚焦图像。RPE中ABCA4的免疫反映性(红色)-ABCA4-tg/ABCA4−/−暴露主要针对RPE的特异性。Abca4-/-和RPE-Abca4-Tg/Abca4-/-小鼠的os层均未被Abca4抗体染色。DAPI核染色为蓝色。

图4.RPE-Abca4-tg/Abca4-/-小鼠RPE中的类双维甲酸、自己荧光和脂褐素水平裁减。
(A-D)从3龄白化小鼠视网膜和RPE匀浆中索求类双维甲酸,弃取正相高效液相色谱法进行分析。RPE/eyecup和神经视网膜索求物的代表性HPLC色谱图见SI附录,图S3。详确,RPE-Abca4-tg/Abca4-/-小鼠RPE中通盘类双维甲酸水平较低。(A)总A2E(A2E和反A2E之和)以每只眼皮摩尔暗示。(B-D)全反式视黄醛二聚体PE(atRAL-Dimer-PE)(B)、A2PE-h2(C)和A2PE(D)以每只眼的毫吸光度单元(mAU)暗示。数据以mean±SD暗示;每组5只;*p

图5.在RPE-Abca4-Tg/Abca4−/−和Abca4−/−小鼠中保留光感受器。
(A)通过光学显微镜赢得的1岁白化病小鼠的代表性视网膜图像。(B)每100μm2细胞面积策画光感受器细胞核总额。详确,与Abca4-/-小鼠比较,RPE-Abca4-tg/Abca4-/-小鼠的ONL细胞数目加多,标明光感受器变性部分归附。数据以mean±SD暗示;N=5-9只/组;RPE-Abca4-Tg/Abca4−/−vs.Abca4−/−,*P=0.0319;Abca4−/−vs.BALB/c,**P

图6所示。ABCA4在RPE内溶酶体膜中的功能。
(A)泛泛RPE细胞。在紫红质卵白水解经过中开释的11cRAL在光腔名义与PE缩合酿成11-顺式-n-视黄醛-磷脂酰酒精胺(11c-N-ret-PE),后者经过异构化酿周详反式(at)和11c-N-ret-PE的搀杂物。两种N-ret-PE异构体齐被ABCA4翻转到细胞质名义,其中Nret-PE的水解是由细胞视黄醛联结卵白(CRALBP)联结11cRAL或视黄醛脱氢酶11型(RDH11)将atRAL还原为atROL的质地作用动手的。atROL由RPE视觉轮回处理,通过卵磷脂视黄醇酰基转机酶(LRAT)酯化生周详反式视黄醇酯,如全反式视黄醇棕榈酸酯(atRP),RPE65异构化生成11-顺式视黄醇(11cROL),视黄醇脱氢酶5型(RDH5)氧化生成11cRAL,并与CRALBP联结。11cRAL使RPE细胞在左近的光感受器OS中再生视觉色素。(B)Abca4−/−突变型RPE细胞。ABCA4-/-小鼠或STGD1患者的RPE内溶酶体中穷乏ABCA4会导致视黄醛的断根蔓延,从而导致游离视黄醛和N-ret-PE浓度升高。这导致atRAL或11cRAL与N-ret-PE二次缩合酿成类双维甲酸。
盘问小结:
ABCA4在RPE细胞中抒发,而况至少部分ABCA4−/−表型是由RPE抒发的ABCA4的缺失引起的。除了光感受器外,RPE细胞也应该行为abca4介导的视网膜变性的调理靶点。
紧迫性:
隐性Stargardt黄斑变性(STGD1)和锥杆养分不良是由ABCB4基因突变引起的。ABCA4卵白是光感受器细胞中的一种翻转酶,有助于排斥视黄醛,一种有毒的视觉光产物。
在这里,咱们发现ABCA4在小鼠视网膜色素上皮(RPE)中也存在,其品貌约为神经视网膜中的1%。在RPE中抒发ABCA4而在光感受器细胞中不抒发ABCA4的转基因小鼠暴露,在ABCA4-/-小鼠和inSTGD1患者中不雅察到的脂褐素积存和光感受器变性均部分归附。这些不雅察成果标明,theRPE中的ABCA4不错回绝ABCA4−/−小鼠以及STGD1患者的光感受器变性。
关连信息:
光感受器细胞外段膜盘中包含视色素,泛泛膜盘不段更新,在视网膜色素变性和某些视网膜病变时,外段膜盘的更新可能出现阻难。
信源:
TamaraL,Lenis,Jane,Hu,SzeYin,Ngetal.ExpressionofABCA4intheretinalpigmentepitheliumanditsimplicationsforStargardtmaculardegeneration.[J].ProcNatlAcadSciUSA,2018,115:0.
参考文件
1.WaldG(1968)Molecularbasisofvisualexcitation.Science162:230–239.
2.RattnerA,SmallwoodPM,NathansJ(2000)Identificationandcharacterizationofall-trans-retinoldehydrogenasefromphotoreceptoroutersegments,thevisualcycleenzymethatreducesall-trans-retinaltoall-trans-retinol.JBiolChem275:11034–11043.
3.QuaziF,LenevichS,MoldayRS(2012)ABCA4isanN-retinylidene-phosphatidylethanolamine
andphosphatidylethanolamineimporter.NatCommun3:925.
4.SunH,NathansJ(1997)Stargardt’sABCRislocalizedtothediscmembraneofretinalrodoutersegments.NatGenet17:15–16.
5.AllikmetsR(1997)Aphotoreceptorcell-specificATP-bindingtransportergene(ABCR)ismutatedinrecessiveStargardtmaculardystrophy.NatGenet17:122.
6.MaugeriA,etal.(2000)MutationsintheABCA4(ABCR)genearethemajorcauseofautosomalrecessivecone-roddystrophy.AmJHumGenet67:960–966.
7.BurkeTR,etal.(2014)QuantitativefundusautofluorescenceinrecessiveStargardtdisease.InvestOphthalmolVisSci55:2841–2852.
8.YoungRW,BokD(1969)Participationoftheretinalpigmentepitheliumintherodoutersegmentrenewalprocess.JCellBiol42:392–403.
9.YoungRW,BokD(1970)Autoradiographicstudiesonthemetabolismoftheretinalpigmentepithelium.InvestOphthalmol9:524–536.
10.MataNL,WengJ,TravisGH(2000)BiosynthesisofamajorlipofuscinfluorophoreinmiceandhumanswithABCR-mediatedretinalandmaculardegeneration.ProcNatlAcadSciUSA97:7154–7159.
11.BoyerNP,etal.(2012)LipofuscinandN-retinylidene-N-retinylethanolamine(A2E)
accumulateinretinalpigmentepitheliuminabsenceoflightexposure:Theiroriginis11-cis-retinal.JBiolChem287:22276–22286.
12.LaVailMM(1976)Rodoutersegmentdisksheddinginratretina:Relationshiptocycliclighting.Science194:1071–1074.
13.StempelAJ,MorgansCW,StoutJT,AppukuttanB(2014)Simultaneousvisualizationandcell-specificconfirmationofRNAandproteininthemouseretina.MolVis20:1366–1373.
14.HuJ,BokD(2010)Cultureofhighlydifferentiatedhumanretinalpigmentepitheliumforanalysisofthepolarizeduptake,processing,andsecretionofretinoids.MethodsMolBiol652:55–73.
15.FengW,YasumuraD,MatthesMT,LaVailMM,VollrathD(2002)Mertktriggersuptakeofphotoreceptoroutersegmentsduringphagocytosisbyculturedretinalpigmentepithelialcells.JBiolChem277:17016–17022.
16.DuncanJL,etal.(2003)AnRCS-likeretinaldystrophyphenotypeinmerknockoutmice.InvestOphthalmolVisSci44:826–838.
17.SethnaS,etal.(2016)Regulationofphagolysosomaldigestionbycaveolin-1oftheretinalpigmentepitheliumisessentialforvision.JBiolChem291:6494–6506.
18.HaeseleerF,etal.(2002)Dual-substratespecificityshortchainretinoldehydrogenasesfromthevertebrateretina.JBiolChem277:45537–45546.
19.KaylorJJ,etal.(2017)Bluelightregeneratesfunctionalvisualpigmentsinmammalsthrougharetinyl-phospholipidintermediate.NatCommun8:16.
20.QuaziF,MoldayRS(2014)ATP-bindingcassettetransporterABCA4andchemicalisomerizationprotectphotoreceptorcellsfromthetoxicaccumulationofexcess11-cis-retinal.ProcNatlAcadSciUSA111:5024–5029.
21.AndersonDMG,etal.(2017)Bis(monoacylglycero)phosphatelipidsintheretinalpigmentepitheliumimplicatelysosomal/endosomaldysfunctioninamodelofStargardtdiseaseandhumanretinas.SciRep7:17352.
22.ChenC,ThompsonDA,KoutalosY(2012)Reductionofall-trans-retinalinvertebraterodphotoreceptorsrequiresthecombinedactionofRDH8andRDH12.JBiolChem287:24662–24670.
23.HarperWS,GaillardER(2001)Studiesofall-trans-retinalasaphotooxidizingagent.PhotochemPhotobiol73:71–76.
24.RaduRA,etal.(2008)AcceleratedaccumulationoflipofuscinpigmentsintheRPEofamousemodelforABCA4-mediatedretinaldystrophiesfollowingVitaminAsupplementation.InvestOphthalmolVisSci49:3821–3829.
25.WengJ,etal.(1999)InsightsintothefunctionofRimproteininphotoreceptorsandetiologyofStargardt’sdiseasefromthephenotypeinabcrknockoutmice.Cell98:13–23.
26.CalameM,etal.(2011)Retinaldegenerationprogressionchangeslentiviralvectorcelltargetingintheretina.PLoSOne6:e23782.
27.NatkunarajahM,etal.(2008)Assessmentofoculartransductionusingsingle-stranded
andself-complementaryrecombinantadeno-associatedvirusserotype2/8.GeneTher15:463–467.
28.CarrAJ,etal.(2009)ProtectiveeffectsofhumaniPS-derivedretinalpigmentepitheliumcelltransplantationintheretinaldystrophicrat.PLoSOne4:e8152.
29.SchwartzSD,etal.(2015)Humanembryonicstemcell-derivedretinalpigmentepitheliuminpatientswithage-relatedmaculardegenerationandStargardt’smaculardystrophy:Follow-upoftwoopen-labelphase1/2studies.Lancet385:509–516.
30.BoulangerA,LiuS,HenningsgaardAA,YuS,RedmondTM(2000)TheupstreamregionoftheRpe65geneconfersretinalpigmentepithelium-specificexpressioninvivoandinvitroandcontainscriticaloctamerandE-boxbindingsites.JBiolChem275:31274–31282.
31.StecDE,MorimotoS,SigmundCD(2001)Vectorsforhigh-levelexpressionofcDNAscontrolledbytissue-specificpromotersintransgenicmice.Biotechniques31:256–258,260.
32.IllingM,MoldayLL,MoldayRS(1997)The220-kDarimproteinofretinalrodoutersegmentsisamemberoftheABCtransportersuperfamily.JBiolChem272:10303–10310.
33.RaduRA,etal.(2011)ComplementsystemdysregulationandinflammationintheretinalpigmentepitheliumofamousemodelforStargardtmaculardegeneration.JBiolChem286:18593–18601.
34.ParishCA,HashimotoM,NakanishiK,DillonJ,SparrowJ(1998)IsolationandonesteppreparationofA2Eandiso-A2E,fluorophoresfromhumanretinalpigmentepithelium.ProcNatlAcadSciUSA95:14609–14613.
35.SchneiderCA,RasbandWS,EliceiriKW(2012)NIHimagetoImageJ:25yearsofimageanalysis.NatMethods9:671–675.
36.LenisTL,etal.(2017)ComplementmodulationintheretinalpigmentepitheliumrescuesphotoreceptordegenerationinamousemodelofStargardtdisease.ProcNatlAcadSciUSA114:3987–3992.
END
案牍|刘卫勤
排版|姜笑南
审核|姜笑南
发布|姜笑南
RECRUIT
关爱咱们,获取人命科学
学界前沿|促进更多的学术换取与结合
业界前沿|促进更快的家具革命与哄骗
战术前沿|促进更好的贬责扩充与发展
抱头摇 裸舞咱们期待你的加入ai换脸 刘亦菲
